

Año XXII. Edición 129. Junio Julio 2025
Comparación de dos procedimientos quirúrgicos como tratamiento a puente portosistémico extrahepático (porto-cava) en perro doméstico. Caso clínico.
PALABRAS CLAVE: Puente portosistémico> extrahepático> banda de celofán oclusor ameroide.

MVZ. EMCPYG. Gabriela Marín-Cano¹
MVZ. Rogelio Alejandro-Rugerio-Estrada²
1 ORCID: https://orcid.org/0009-0001-5701-5612.
2 ORCID: https://orcid.org/0009-0002-6025-2237.
Universidad Autónoma del Estado de México.
Hospital Veterinario de Pequeñas Especies.
Introducción
El puente portosistémico es una anormalidad vascular en la que la vena porta hepática se conecta directamente con la circulación sistémica, comunmente presentando signología clínica postpandrial en pacientes jóvenes, esto debido a que la sangre venosa que drena al bazo, al páncreas, estómago e intestino, entran a la vena porta, perfunde al hígado por los sinusoides y finalmente desenvoca en la vena cava, acarreando residuos hormonales provenientes del intestino y del páncreas, nutrientes, productos y toxinas derivadas del intestino. Caso Clínico: Se presenta a consulta al HVPE un paciente perro doméstico raza schnauzer hembra entera, de 1 año de edad, el cuál presentó signología neurológica post pandrial, caracterizada por desplazamiento errático, recargaba la cabeza en superficies, presentaba la mirada perdida y hocico abierto sin razón aparente, además de fatiga al realizar actividad física e inapetencia, la cual cesaba pocas horas después de ingerir alimentos. Se realizan estudios de laboratorio (Hg, PB, UA, medición de amoniaco sérico) y estudios de imagen (ultrasonido abdominal y tomografía coputarizada) donde se diagnostica: Puente Portosistémico extra hepático porto-cava, el cual fue sometido a procedimiento quirúrgico ( colocación de banda de celofán) el cual no fue concluyente como tratamiento definitivo debido al aumento en medición de amoniaco del paciente, así como persistencia de shunt portosistémico en tomografia computarizada post quirurgica (10 meses después).
Contribuciones
Se describe el procedimiento quirúrgico de colocación de banda de celofán como tratamiento de puente portosistémico extra hepático porto-cava, la no resolución de éste y a modo de discusión, el procedimiento de colocación de oclusor ameroide como tratamiento definitivo y comparar los rangos de eficacia entre éstos.

Introducción
El hígado en los perros y gatos cuenta como el 3-4% del peso corporal del paciente, está situado casi en su totalidad por la cavidad torácica, unicamete sobresaliendo del arco costal en la región derecha, donde se ubica el proceso caudal de este y contacta el riñon derecho, el cual está situado hacia craneal en comparación con su contraparte, éste se compone de divisiones, las cuales son llamadas lóbulos:
• Lóbulo lateral y medial izquierdo.
• Lóbulo cuadrado.
• Lóbulo medial y lateral derecho.
• Lóbulo caudado.
El borde craneal de éste se contacta directamente con la curvatura del diafragma y se encuentra fijada por la vena cava caudal en el borde dorsal. Su inserción en el centro tendinoso del diafragma es por los ligamentos coronarios derecho e izquierdo, los cuales se encuentran caudo laterales a la vena, esto le da la propiedad al hígado de retraerse durante un procedimiento quirúrgico.
El ligamento hepatogástrico contiene el ducto biliar, la arteria hepática, vena porta, vasos linfáticos y la irrigación nerviosa, una vez que se conecta con el ducto cístico de la vesícula biliar, se conoce como ducto biliar común. (Singh, 2018).
Una de las funciones del hígado es la secretora, por medio de la bilis en el tracto digestivo, la vesícula biliar se conecta con el duodeno por medio del esfínter de Oddi, esta secreción compuesta principalmente por fosfolípidos y colesterol en solución acuosa, que presenta acción detergente, sirve como metabolizador de las grasas provenientes de los alimentos.
Está compuesto de láminas o capas de hepatocitos, los cuales están rodeados e irrigados por sangre procedente de los hepatocitos, estos canales se unen por canales (canalículos) que conectan con los conductos biliares, los hepatocitos secretan la bilis a los canalículos y de ahí a los conductos. Esta bilis se sintetiza a partir del colesterol, se crean cambios químicos para convertir éste en ácido cólico, creando una molécula parte hidrosoluble y otra liposoluble, esta característica de hidrófila e hidrófoba es una propiedad detergente. El principal pigmento biliar es la bilirrubina, que se genera en el proceso de recambio de glóbulos rojos en la sangre, en el intestino, por acción de bacterias, cambia el pigmento y se les proporciona a las heces. (Klein B. 2014).
Como se mencionó, la irrigación normal del hígado es mediante los sinusoides hepáticos por la vena porta y arteria hepática, la vena porta se conecta con el bazo, el páncreas, estómago y finalmente con la vena cava, los puentes portosistémicos se presentan como una condición en la que este flujo sanguíneo se saltan los sinusoides hepáticos y van directo a la circulación sistémica, estos se clasifican de acuerdo con su origen y la conexión que presentan con el sistema circulatorio sistémico:
• Congénito.
° Puente portosistémico macrovascular.
° Intrahepático.
° Extrahepático.
° Hipoplasia primaria de la vena porta.
° Asociado a hipertensión portal.
° Sin hipertensión portal.
° Distorsión del flujo de salida.
• Adquirido.
° Puentes portosistémicos extrahepáticos múltiples.
° Secundario a fibrosis hepática (Cirrosis)
° Secundaria a malformaciones arteriovenosas hepáticas.
Los tipos de comunicaciones sistémicas son: porto-cava intra y extrahepáticos; porto-acigos extrahepático; atresia de la vena porta con anastomosis porto-cava; malformaciones arteriovenosas hepáticas las cuales causan hipertensión portal, creando una apertura de las anastomosis portosistémicas y finalmente puentes microintrahepáticos. El más común es la presentación de un único puente portosistémico porto-cava, el cual constituye el 66-75% de las anomalías congénitas en perros y gatos. (Ettinger, S. et al. 2017) .
La mayoría de los puentes portosistémicos intra hepáticos ocurren en perros de razas grandes, sin embargo, los puentes extrahepáticos se diagnostican con mayor frecuencia en pacientes de raza pequeña, algunos de éstos presentan diferentes signos clinicos, siendo en menor grado de severidad los extrahepáticos de tipo espleno-cava, de los cuales el flujo no proviene principalmente de tracto gastrointestinal y la cantidad de sagre que pasa a la circulación sistémica es poca, por el contrario con los puentes porto-cava, los cuales acumulan toxinas de tracto gastrointestinal, así como productos de desecho. La signología clinica dependiendo de la severidad del puente, se presenta en pacientes con edades de 1-2 años, en caso de que sean adquiridos, se pesentan en una edad aproximada de mas de 10 años. (Ettinger, S. et al. 2017)
La signología clinica y la fisiopatología involucra una multitud de otras toxinas y factores también están implicados en su patogénesis, como el estrés oxidativo, los ligandos endógenos similares a las benzodiazepinas, la inflamación de los astrocitos, las moléculas similares al ácido g-aminobutírico, la neurotransmisión anormal de histamina y serotonina, los opioides endógenos, los neuroesteroides, las citocinas inflamatorias y la posible toxicidad del manganeso. Secundario a la encefalopatía se presenta edema cerebral y éste se debe en parte a la captación de amoníaco por los astrocitos, donde se combina con el glutamato intracelular para producir glutamina, la cual causa inflamación celular. Sin embargo, el grado de encefalopatía no se asocia adecuadamente con los niveles de amoníaco en sangre. La hipótesis del amoníaco por sí sola no explica completamente la fisiopatología. (Konstantinidis, A. et al. 2023)
Es frecuente observar un aumento leve o moderado de la actividad de las enzimas hepáticas séricas (fosfatasa alcalina, FA; alanina aminotransferasa, ALT; aspartato aminotransferasa, AST). Se puede observar hipoalbuminemia, hipoproteinemia, hipocolesterolemia y baja concentración de urea debido a la reducción de la síntesis hepática. La hipoglucemia puede deberse a una disminución de la gluconeogénesis hepática y del almacenamiento de glucógeno. La baja concentración sérica de creatinina y urea puede deberse a un aumento de la tasa de filtración glomerular. (Konstantinidis, A. et al. 2023)
Para el diagnóstico de la patología se puede evaluar mediante signología clinica, la cual es característica de encefalopatía hepática, además de vómitos y diarrea, sin embargo, se pueden realizar estudios de laboratorio para determinar la concentración serica de enzimas estructurales y de funcionalidad hepática, asi cómo pruebas más específicas por ejemplo la medición de amoniaco sérico post-pandrial. Los apoyos de estudios de imagen se basan en ultrasonido y tomografía computarizada. Los hallazgos comunes son microhepática, visibilidad reducida de las ramas hepática y porta, presencia de un vaso anómalo o riñones agrandados, y una relación vena porta/aorta reducida. También se puede identificar turbulencia en el flujo sanguíneo en la región de inserción del puente congénito al sistema venoso sistémico. El diagnóstico requiere la obtención de imágenes del vaso anómalo desde su origen hasta su terminación. (Konstantinidis, A. et al. 2023)
El tratamiento, en pacientes con signología clinica, en casos en los que el shunt es congénito, se recomienda el procedimiento quirúrgico y como tratamiento de soporte general del paciente con encefalopatía hepática debe incluir fluidoterapia (cloruro de sodio al 0,9 % o cloruro de sodio al 0,45 % y dextrosa al 2,5 %), normalización del equilibrio ácido-base y suplementación de minerales que se requieran, se debe administrar una dieta altamente digestible cuya principal fuente de calorías sean los carbohidratos, que el origen de la proteina sea vegetal para mejor tolerancia del paciente. El uso de antibioticos se ha discutido para reducir la microbiota que produce alta cantidad de toxinas.
El tratamiento en pequeños animales actualmente se utilizan constrictores ameroides o bandas de celofán, con un constrictor ameroide, la constricción inicial se produce por la hinchazón del material higroscópico dentro del dispositivo, se produce una oclusión adicional de la derivación a medida que se desarrolla fibrosis alrededor del vaso. Es importante destacar que la tasa de oclusión vascular puede afectar la propensión del animal a desarrollar derivaciones adquiridas después de la oclusión. (Fossum T. 2019)
Los constrictores ameroides vienen en varios tamaños; aquellos con diámetro interno de 3,5 a 5 mm son los utilizados con mayor frecuencia para la ligadura de las derivaciones portosistémicas extrahepáticas. El tamaño del constrictor ameroide depende del diámetro del vaso anómalo; por lo tanto, para cada cirugía se debe disponer de varios tamaños. El diámetro ideal es el que no produzca constricción al momento de la colocación. Debido a que se pueden desarrollar derivaciones adquiridas con mayor frecuencia en los pacientes que han recibido un implante de 3,5 mm, se recomienda el uso de constrictores con diámetro interno mínimo de 5 mm. Los constrictores ameroides son esterilizados con gas y, por lo tanto, no deben ser utilizados hasta 12 a 24 horas después de su esterilización, para permitir que el óxido de etileno residual sea liberado desde la caseína (Slatter, 2006).
Antes de colocar el constrictor, la “llave” (una pequeña columna de caseína que completa el anillo constrictor) es removida del constrictor ameroide y se la guarda en un recipiente seco. El constrictor es sostenido con seguridad con un par de pinzas Allis, evitando la rotación de la caseína dentro del anillo de acero inoxidable. La disección de la fascia de soporte que rodea el vaso anómalo es realizada al mínimo posible, para evitar el movimiento posquirúrgico del anillo y lograr una obstrucción adecuada del vaso de derivación. Una vez realizada la abertura en la fascia adyacente al vaso anómalo, este es aplanado elevándolo con una pinza de ángulo recto abierta o con dos hilos de seda. El constrictor se desliza sobre el vaso y la “llave” se vuelve a colocar dentro del constrictor. Si es difícil de colocar esta llave, se puede eliminar un poco de caseína desde sus extremos. Si esta llave se pierde o no se puede usar, el anillo interno de caseína puede ser rotado de forma tal que la abertura mire en dirección opuesta a la de la abertura del anillo de acero inoxidable (Slatter, 2006).
La banda está formada por el plegamiento (en 3 veces) de una banda de 1,2 cm de ancho de celofán esterilizada con óxido de etileno. El extremo es hecho en punta para facilitar su pasaje, y la banda es pasada alrededor del vaso anómalo. El grado de oclusión es predeterminado por la colocación de una barra metálica en L o un catéter de goma roja del diámetro deseado a lo largo del vaso de derivación y se ajusta la banda alrededor del vaso anómalo y de la barra o el catéter. Luego, una banda es mantenida en posición por medio de agrafes vasculares y se remueve la barra o el catéter. El paciente es evaluado en forma objetiva o subjetiva en busca de evidencia de hipertensión portal. Los hemoclips pueden deslizarse a lo largo del celofán para ajustar la comprensión; una vez determinada la colocación final, el celofán es suturado para evitar que se afloje. La fibrosis estimulada por el celofán provoca, en la mayoría de los perros, la oclusión del vaso anómalo en unas 8 semanas de colocada la banda. Cuando el diámetro interno de la banda es mayor a 3 mm, es poco probable que se produzca una oclusión completa del vaso de derivación (Slatter, 2006).
Las bandas de celofán provocan una respuesta inflamatoria aguda, seguida de una reacción tisular crónica de bajo grado a cuerpo extraño. Existe una proporción mas baja de éxito quirúrgico con la colocación de las bandas de celofán que con los constrictores ameroides, sin embargo, la resolución de la signología clínica es significativa en ambos casos, al igual que los constrictores ameroides, existe riesgo de presentación de derivaciones vasculares posteriores a la aplicación de estas. (Fossum T. 2018)
Introducción
Se describe el caso clínico de un paciente Schnauzer de 6 meses, hembra no esterilizada. El tutor acude al hospital veterinario de Pequeñas Especies de la Universidad Autónoma del Estado de México con sede en Toluca, Estado de México (19.2785190, -99.6577581) reporta que el paciente antes mencionado presentaba caminata pegada a la pared sin rumbo aparente y con estado mental alterado (deprimido) después de ingerir alimentos, con cronicidad de 3 meses, por lo cual se le realizan estudios de laboratorio (Hemograma, Perfil Bioquimico, Urianalisis, medición de amoniaco sérico) realizado con el equipo Dymind DF56 Vet y Seamaty VG2 respectivamente, estudios de imagen de ultrasonido abdominal con el equipo Sonoscape p15 y tomografía computarizada con el equipo MyVet CT i3D, con los cuales se diagnostica a la paciente con puente portosistémico extrahepático poto-cava, el cual causa dilatación de la vena cava abdominal craneal al puente portosistémico, de manera secundaria se observa microhepatía severa.
La paciente se ingresa a hospitalización de urgencias donde se instaura tratamiento antibiótico (ampicilina), quelantes de amoniaco (lactulosa) y terapia de líquidos con soluciones isotónicas cristaloides (Ringer lactato) a razón de 60 ml/kg.



Posteriormente se realizó procedimiento quirúrgico colocación de banda de celofán, como tratamiento al puente portosistémico, el cual se realizó en quirófano 1 del Hospital Veterinario de Pequeñas especies de la Universidad Autónoma del Estado de México, iniciando con la preparación del paciente en área negra (tricotomía y lavado quirurgico en 3 tiempos con clorhexidina al 4%) posteriormente se ingresa a área gris y continua su traslado a área blanca donde el personal de anetesia realiza maniobras pre operatorias las cuales constan de premedicaciones: Meloxicam (0.2 mg/Kg IV), Lidocaína (2 mg/kg IV) y preoxigenación a razón de 2L/min durante 15 minutos, una vez premedicada se induce a la paciente usando el protocolo: Ketofol 3:3 (Propofol 3 mg/ kg IV y Ketamina 3 mg/kg IV); Midazolam (0.3 mg/kg IV); Cisatracurio (0.2 mg/kg IV) e iniciando una infusión intravenosa de fármacos analgesicos trans y postquirúrgica.
Ya en decubito dorsal, se embroca el sitio quirúrgico en 3 tiempos alternando clorhexidina al 4% y alcohol al 70% de manera centrifuga, una vez concluido y previo lavado quirúrgico del personal de tejidos blandos (cirujano, primer ayudante e instrumentista) se inicia el procedimiento ubicando linea media y realizando una incisión con aguja de bisturí del número 24, se realiza un desbride romo a modo de ubicar y dar seguimiento a la vena cava caudal y sus ramificaciones, hacia el flanco izquierdo del paciente, hasta el polo caudal del riñón derecho, donde seguido de un desbride romo de tejido graso, se evidenció una rama venosa anomala identificandola como el puente portosistémico, se continuó el desbride a modo de liberar totalmete el vaso sanguíneo, seguido de ello se colocó por debajo del mismo una pinza satinsky con la cual se sujetó un borde de la banda de celofán y dirigirlo por debajo del vaso para continuar rodeandolo por completo, se colocaron puntos de sutura en X con material absorbible ácido poliglicólico 2-0, seguido de ello se cerró la capa muscular abdominal con sutura absorbible en un patrón continuo simple, reforzando los mismos con un patrón interrumpido en X invertida, para finalizar el procedimiento se realizó un patrón continuo subcuticular, seguido de un refuerzo de puntos simples interrumpidos con material de sutura no absorbible nylon 3-0.
Resultados.
La paciente se da de alta el 21 de junio del 2024, acude a revisión el día 12/08/2024 donde la paciente no reporta alteraciones en el estado mental post pandrial o signología neurológica. Nuevamente se realizan estudios de laboratorio (Hemograma, Quimica sanguínea, Urianalisis y medición serica de amoniaco) a modo de contar con estudios control donde se obtiene disminución de urea y elevación de amoniaco sérico el día 02 y 07 de octubre del 2024 respectivamente.
Por lo que se recomienda realizar nuevamente estudio de imagen avanzada (tomografía computarizada). Donde se describe el parenquima hepático con disminución del volumen sin lesiones evidentes, pero continua presentando microhepatía, sin embargo, se observa nuevamente el shunt portosistémico porto-cava, en la misma ubicación reportada que la ultima ocasión. Se realiza medición de éste el cual se obtuvo un total de 1.7 cm de longitud así como notable proximidad de la luz del shunt con la vena cava.


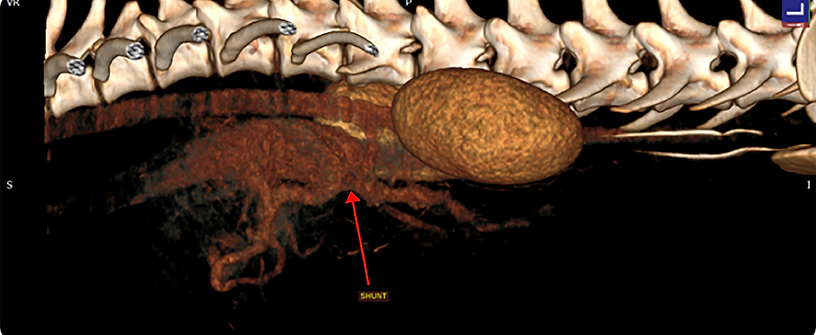
Discusión.
La oclusión del puente portosistémico puede variar dependiendo del calibre del vaso, la ubicación del shunt y las caracteristicas del procedimiento quirúrgico, la colocación de dispositivos ameroides ocasiona un cierre total del shunt en 14 a 35 días post quirurgicos, el grado de la oclusión determina la prognosis del paciente, si se ocluye demasiado, el paciente puede crear hipertensión portal fatal y causar el deceso del paciente. (Bright S. et al. 2006).
Otra complicación reportada si se ocluye un puente portosistémico demasiado rápido, es la creación de nuevas derivaciones de los vasos alrededor del shunt principal, además se menciona que si el vaso no es ocluido en su totalidad, aún el paciente permanece con un pronóstico favorable y se ha demostrado que la colocación de dispositivos ameroides reduce los tiempos de cirugía y complicaciones transquirurgicas. (Ettinger, S. et al. 2017).
Se ha generado especulación de la capacidad de regeneración del tejido del hígado posteriormente a la atenuación del puente portosistémico, teorias indican que puede determinarse debido al diametro y disposición de la vasculatura. Ademas se determinó que en pacientes con un diametro menor de masa hepática pre operatoria, aumentan significativamente la proporción de masa hepática post operatoria, en comparación a aquellos que presentaban una proporción de masa hepática normal o similar a la normal determinada por su peso.
En un estudio realizado en 2019 por Matiasovic, M., Chanoit, G. P. A., Meakin, L. B., & Tivers, M. S., se menciona que las tasas de complicaciones postoperatorias para ambos grupos fueron comparables (28% para banda de celofán frente a 35% para constrictor ameroide). El retardo en el cierre de la anormalidad vascular puede estar determinada por la composición del material de la banda, asi como de las condiciones en que se esterilice, se coloque y el tipo de reacción inflamatoria del paciente. En este mismo estudio observaron la generación en mayor proporción de vasos residuales posteriormente a la colocación de banda de celofán en comparación a la aplicación de constrictor ameroide.
En otro estudio realizado por Traverson, M., Lussier, B., Huneault, L., & Gatineau, M. en el año 2017, se reportan 49 casos de puentes portosistémicos extrahepáticos tratados 23 con anillo constrictor ameroide (3.5 mm, 5mm y 6mm) y 26 con banda de celofán (3mm, 4mm y 5mm), 10 pacientes con anomalía porto cava, con controles al mes de la cirugía, 1-6 meses de realizada la cirugía y más de 6 meses, los autores concluyen que si bien ambos procedimientos son seguros por la baja tasa de mortalidad y morbilidad provados en atenuación de puentes portosistémicos, la atenuación de la banda de celofán ante ciertas condiciones como el método de esterilización (oxido de etileno, radiación gamma y peroxido de hidrogeno), manejo y composición de la misma pueden reducir la fuerza tensil y no generar una completa oclusión del vaso. Similar a lo reportado en el estudio anterior.
En otro estudio realizado por Otomo, A., Singh, A., Jeong, J., Dobberstein, R., Lundhild, A., Peter, E., Milovancev, M. en el 2020 realizaron un compendio de 123 pacientes atendidos por presencia de puentes portosistémicos extrahepáticos del Centro de Ciencias de la Salud de la Facultad de Veterinaria de Ontario, Universidad de Guelph y Facultad de Medicina Veterinaria Carlson de la Universidad Estatal de Oregon, concluyen de forma similar a estudios realizados mencionados anteriormente, comentan que la estructura ideal para la colocación de la banda de celofán es la celulosa y los rangos de complicaciones post operatorias a razón de no atenuación, signos neurológicos o complicaciones a corto plazo que requirieron nuevamente intervención quirúrgica, entre banda de celofán y constrictor ameroide, fueron similares, sin variación significativa entre ambos métodos de atenuación de las anomalías vasculares.
Se ha reportado en comparación de varios métodos de atenuación de puentes portosistémicos extrahepáticos realizado por Youmans, K. R., & Hunt, G. B., que la banda de celofán y el constrictor ameroide causan una atenuación similar de éstos, sin embargo, al igual que en estudios anteriores, la tasa de atenuación incompleta de la banda de celofán es mas alta. El anillo ameroide causa un cierre total y más rapido del shunt, a diferencia de la banda que demora más pero que es gradual y por consecuencia más segura.
En el caso del paciente antes descrito, no hay al momento evidencia científica que exponga la eficacia del constrictor ameroide en el caso del puente portosistémico con las medidas antes mencionadas, si bien el constrictor ameroide proporciona un cierre total y mas rápido del puente portosistémico, las dimensiones y la cercanía del puente con los grandes vasos (vena porta), vuelven un tanto complicado el uso del constrictor ameroide, debido a la necesidad de ocluir hasta el 35% del vaso, lo que indica en éste caso el uso de mayor diámetro del oclusor y poca viabilidad de sus medidas pre fabricadas, la banda de celofán si bien corre el riesgo de crear derivaciones y una oclusión incompleta del vaso, proporciona mayor seguridad en el quirófano y en el periodo post quirúrgico, por lo que en el caso de éste puente portosistémico, varios factores a considerar se han abordado, como la atenuación de la fuerza tensil de la banda de celofán, la elección del material del cual se compone para evitar riesgos de fallo quirúrgico, las eventualidades que pueden ocurrir en el periodo post quirurgico y el tiempo que toma en ocluir el defecto vascular, todo esto influye en la nueva toma de decisiones en la planeación del procedimiento y qué esperar a consideración de lo antes expuesto.
Conflicto de intereses.
«Los autores no tienen ningún conflicto de intereses que
declarar en relación con esta publicación».
Referencias:
-
Klein B. (2014) Cunningham´s textbook of veterinary physiology. ELSEVIER. (5th) P. 292-295.
-
Ettinger S, et Al. (2017) Textbook of Veterinary Internal Medicine. ELSEVIER. (8th). P. 4008- 4019.
-
Konstantinidis A., et al. (2023) Congenital Portosystemic Shunts in Dogs and Cats: Classification, Pathophysiology, Clinical Presentation and Diagnosis. MPDI. Obtenido de: https://www.mdpi.com/2306-7381/10/2/160
-
Nelson, N. C., & Nelson, L. L. (2011). Anatomy of extrahepatic portosystemic shunts in dogs as determined by computed tomography angiography. Veterinary Radiology & Ultrasound, 52(5), P 498–506. Obtenido de: https://onlinelibrary.wiley.com/doi/full/10.1111/j.1740-8261.2011.01827.x
-
Bright, S. R., et al.. (2006). Outcomes of Intrahepatic Portosystemic Shunts Occluded with Ameroid Constrictors in Nine Dogs and One Cat. Veterinary Surgery, 35(3), P 300–309.doi:10.1111/j.1532-950x.2006.00148.x
-
Kyles, A. E., et al.. (2001). Evaluation of a portocaval venograft and ameroid ring for the occlusion of intrahepatic portocaval shunts in dogs. Veterinary Surgery, 30(2), P 161–169. doi:10.1053/jvet.2001.20333
-
Zwingenberger, A. L., et al. (2014). Correlation Between Liver Volume, Portal Vascular Anatomy, and Hepatic Perfusion in Dogs With Congenital Portosystemic Shunt Before and After Placement of Ameroid Constrictors. Veterinary Surgery, 43(8), P 926–934. doi:10.1111/j.1532-950x.2014.12193.x
-
Traverson, M., Lussier, B., Huneault, L., & Gatineau, M. (2017). Comparative outcomes between ameroid ring constrictor and cellophane banding for treatment of single congenital extrahepatic portosystemic shunts in 49 dogs (1998-2012). Veterinary Surgery, 47(2). doi:10.1111/vsu.12747
-
Matiasovic, M., Chanoit, G. P. A., Meakin, L. B., & Tivers, M. S. (2019). Outcomes of dogs treated for extrahepatic congenital portosystemic shunts with thin film banding or ameroid ring constrictor. Veterinary Surgery. doi:10.1111/vsu.13273
-
Otomo, A., Singh, A., Jeong, J., Dobberstein, R., Lundhild, A., Peter, E., … Milovancev, M. (2020). Long-term clinical outcomes of dogs with single congenital extrahepatic portosystemic shunts attenuated with thin film banding or ameroid ring constrictors. Veterinary Surgery. doi:10.1111/vsu.13384
-
Murphy, S., Ellison, G., Long, M., & Van Gilder, J. (2001). A comparison of the Ameroid constrictor versus ligation in the surgical management of single extrahepatic portosystemic shunts. Journal of the American Animal Hospital Association, 37(4), p 390–396. doi:10.5326/15473317-37-4-390
-
Youmans, K. R., & Hunt, G. B. (1999). Experimental Evaluation of Four Methods of Progressive Venous Attenuation in Dogs. Veterinary Surgery, 28(1), p 38–47. doi:10.1053/jvet.1999.0038
-
YOUMANS, K., & HUNT, G. (1998). Cellophane banding for the gradual attenuation of single extrahepatic portosystemic shunts in eleven dogs. Australian Veterinary Journal, 76(8), 531–537. doi:10.1111/j.1751-0813.1998.tb10208.x
-
Hunt, G. B., Kummeling, A., Tisdall, P. L. C., Marchevsky, A. M., Liptak, J. M., Youmans, K. R., … Beck, J. A. (2004). Outcomes of Cellophane Banding for Congenital Portosystemic Shunts in 106 Dogs and 5 Cats. Veterinary Surgery, 33(1), 25–31. doi:10.1111/j.1532-950x.2004.04011.x
-
Sereda, C. W., & Adin, C. A. (2005). Methods of Gradual Vascular Occlusion and Their Applications in Treatment of Congenital Portosystemic Shunts in Dogs: A Review. Veterinary Surgery, 34(1), 83–91. doi:10.1111/j.1532-950x.2005.00015.x
-
Slatter D. (2006). Tratado de cirugía en pequeños animales, volumen IV, (3ra) , capítulo 45. Inter-Médica. Buenos Aires, Argentina.
-
Singh, B., & Dyce, K. M. (2018). Dyce, Sack, and Wensing's textbook of veterinary anatomy (5.ª ed.). Elsevier.
-
Singh, B., & Dyce, K. M. (2018). Dyce, Sack, and Wensing's textbook of veterinary anatomy (5.ª ed.). Elsevier.



