

Año XXII. Edición 130. Agosto Septiembre 2025
Consideraciones
Anestésicas en el Gato. Parte 1.
PALABRAS CLAVE: Anestesiología veterinaria > riesgo anestésico > ceguera postanestésica.
Dr. en C. Esp. Julio Raúl Chávez Monteagudo¹,³,⁴
Dr. en C. Esp. Marco Antonio De Paz Campos ²,³,⁴
Dr. en C. Esp. José Antonio Ibancovichi Camarillo ³,⁴
-
Anestesiología y Urgencias. Profesor de Tiempo Completo. Hospital de Pequeñas Especies. Facultad de Estudios Superiores Cuautitlán. Universidad Nacional Autónoma de México. UNAM.
-
Farmacología y Medicina Interna. Profesor de Tiempo Completo. Hospital de Pequeñas Especies. Facultad de Estudios Superiores Cuautitlán. Universidad Nacional Autónoma de México. UNAM.
-
Colegio Mexicano de Anestesiología y Analgesia Veterinaria.
-
Asociación Mexicana de Anestesiología, Analgesia y Reanimación Veterinaria.

Resumen
El riesgo anestésico en el gato, la medicación previa al examen preanestésico, la cateterización venosa, la farmacocinética y farmacodinamia de los sedantes y de los anestésicos inyectables e inhalatorios, la elección del circuito anestésico, la infusión continua de lidocaína y dexmedetomidina, el manejo de la vía aérea, así como las complicaciones asociadas al procedimiento anestésico, son algunos de los factores por considerar para proporcionar un procedimiento anestésico seguro.

Mortalidad anestésica
En un estudio sobre mortalidad anestésica en perros y gatos, sabemos que esta es mayor en los gatos (0.24% en el gato y 0.17% en el perro)¹. Cuando se trata de procedimientos anestésicos en estas dos especies, debemos de tener presente que existen diferencias más allá del tamaño. En gatos, por ejemplo, se recomienda mayor cuidado en el manejo de la vía aérea y la fluidoterapia durante en el periodo perioperatorio ². Aquí se muestran algunas de las principales consideraciones cuando se realicen procedimientos anestésicos en gatos.
Medicación previa a la consulta veterinaria.
Para incrementar la calidad de la atención médica y poder realizar el examen físico completo en aquellos gatos que no están acostumbrados a la manipulación, así como en los que son de temperamento ansioso/temeroso y que han tenido experiencias negativas previas, el American Association of Feline Practitioners (AAFP) y la International Society of Feline Medicine (ISFM) publicaron en 2022 las guías de manejo amigable conocido como Cat Friendly en donde se recomienda administrar gabapentina a dosis de 20 mg/Kg de 2 a 3 horas antes del evento estresante o administrar de 100 a 200 mg totales por gato.
Estas dosis de gabapentina se consideran seguras ya que no se observan efectos cardiovasculares importantes ³. El efecto de la gabapentina estará presente hasta por 8 horas y algunos gatos podrán mostrar dificultad para realizar movimientos precisos o presentar sedación moderada. Es poco probable la presentación de vómitos y diarreas a estas dosis. Debido a que la excreción de la gabapentina es 100% por vía renal, se recomienda administrar menos de 10 mg/Kg en gatos con enfermedad renal crónica ⁴. También, el AAFP recomienda administrar 60 minutos antes de la manipulación 10 mg/Kg de trazodona o 50 a 100 mg totales por gato3. En un estudio donde se administró 5 mg/kg de trazodona por vía oral, se informó que se absorbe rápidamente y no da lugar a efectos adversos. A estas dosis, el efecto de la trazodona puede estar presente de 6 hasta 8 horas ⁵ y la administración de 10 mg/Kg de gabapentina en conjunto con trazodona no incrementa el efecto que estos fármacos producen cuando se administran por separado.
Uso de Benzodiacepinas:
No es recomendable la administración de diazepam por vía intramuscular debido a que es hidrofóbico y su absorción por esta vía es impredecible. En su caso es mejor la utilización de midazolam por esta vía. También, el diazepam contiene propilenglicol y puede causar dolor y flebitis cuando se administra por vía intravenosa por ser una solución hiperosmolar. Puede provocar toxicidad cardíaca y depresión cardiovascular si se administra de manera repetida y a una rápida velocidad. El diazepam sufre biotransformación lenta en gatos y acumulación en ácidos biliares, lo cual puede producir lesión hepática después de la administración repetida ⁶. El Midazolam es soluble en agua, no genera flebitis ni daño hepático y es la benzodiazepina de elección en los gatos.
Imagen 1. Vena Safena medial en el gato.
Debido a que la vía aérea de los gatos es más pequeña y a que presenta mayor capacidad de respuesta laríngea a la estimulación mecánica ⁷, la técnica de intubación orotraqueal debe de ser diferente a la utilizada en los perros (imagen 2).
Manejo de la vía aérea.
La vena cefálica es normalmente el vaso sanguíneo utilizado para cateterizar al perro y al gato, sin embargo, en caso de no ser posible, es recomendable usar la vena safena medial en el gato (imagen 1).
Acceso Venoso.


Imagen 2. Intubación orotraqueal en decúbito dorsal en el gato.
En el gato, se genera espasmo laríngeo por la estimulación del paladar blando, faringe, laringe y de la tráquea ⁸, así como ruptura traqueal por una mala técnica de intubación⁹. Es necesario aplicar lidocaína de manera tópica en los cartílagos aritenoides y esperar 45 segundos para poder colocar el tubo orotraqueal ¹⁰. En caso de no contar con solución de lidocaína en spray laringofaríngea de uso veterinario (Intubeaze de Dechra), se puede administrar hasta 2 mg/kg de la solución inyectable de lidocaína al 2% (suele ser suficiente administrar 0.05 – 0.1 ml en cada cartílago). Es indispensable que la intubación orotraqueal se realice en gatos con un plano anestésico adecuado y que este canalizado para poder titular las dosis del fármaco inductor y mejorar las condiciones de la intubación. En caso de ser necesario el cambio de posición del paciente, se recomienda desconectar el circuito anestésico antes de mover al gato con el objetivo de evitar lesión de la tráquea. De igual manera, el inflado del balón de neumotaponamiento del tubo orotraqueal debe de ser cuidadoso y no exceder la presión de perfusión tisular traqueal (25 – 30 mmHg). El uso de jeringas con manómetro o jeringas Tru-Cuff puede ayudar a inflarlo con la presión adecuada (imagen 3).

IImagen 3. Jeringas Tru-Cuff para el inflado del balón de neumotaponamiento.
Uso del Propofol.
El propofol esta indicado para la inducción de la anestesia de perros y gatos, sin embargo, los gatos tienen una capacidad mas baja de conjugación de glucurónidos para el metabolismo de los compuestos fenólicos. Esto conduce a la acumulación de propofol y recuperaciones prolongadas en gatos anestesiados con técnicas de anestesia total intravenosa (TIVA) que duran más de 30 minutos. Existe evidencia sobre la formación de cuerpos de Heinz, malestar generalizado, edema facial, anorexia y diarrea en gatos anestesiados en días consecutivos, así como incremento en los tiempos de recuperación ¹¹.¹². Se recomienda precaución en prodedimientos anestésicos en días consecutivo y por tiempos prolongados en gatos.
Circuitos anestésicos.
En gatos y perros con un peso menor a 5 Kg es recomendable utilizar circuitos de no reinhalación (Bain). Debemos de considerar que estos circuitos requieren flujos de mantenimiento mayores (para evitar la reinhalación de CO2) a los circuitos de reinhalación, tomando en cuenta que pueden disminuir la temperatura corporal y resecar las vías aéreas. Se pueden utilizar circuitos de reinhalación en pacientes de menor tamaño siempre y cuando sean capaces de mover las válvulas unidireccionales en ventilación espontánea sin que se produzca fatiga respiratoria. En caso de observar hipoventilación será necesario proporcionar apoyo ventilatorio.
Infusión continua de dexmedetomidina.
Infusión continua de Lidocaína.
La administración intravenosa de lidocaína en gatos reduce la concentración alveolar mínima de isoflurano, pero genera depresión cardiovascular. No se recomienda la administración de lidocaína en infusión continua para reducir los requerimientos de anestésicos inhalatorios en gatos ¹⁴.
Concentración alveolar mínima.
La concentración alveolar mínima (CAM) se define como la concentración mínima de un anestésico inhalatorio necesaria en el alveolo, a 1 atmosfera de presión (presión atmosférica a nivel del mar 760 mmHg), que produce inmovilidad en el 50% de los sujetos expuestos a un estímulo doloroso supramáximo¹⁵ (CAM50). La CAM necesaria para realizar procedimientos quirúrgicos se conoce como CAM quirúrgica (produce inmovilidad en el 95% de los sujetos) y es equivalente a 1.3 veces la CAM50, es decir, si la CAM50 del isoflurano en el perro es de 1.4% ¹⁶, la CAM quirúrgica resulta de multiplicar 1.4% X 1.3, obteniendo 1.8% como CAM quirúrgica. La CAM de sevoflurano en el perro es de 2.6%17 y la del desflurano es de 10%18, sin embargo, la CAM de los diferentes anestesicos inhalatorios en el gato es mas alta, siendo estas 2.2% del isoflurano ¹⁹, la del sevoflurano es de 3.4% y del desflurano es de 10.27% ²⁰.
Ceguera cortical postanestésica.
En los gatos, existen reportes de ceguera posterior a un procedimiento anestésico ²¹. Se considera que es causada por la disminución de la perfusión cerebral por compresión de la arteria maxilar ²² cuando se realiza apertura completa de la cavidad oral (imagen 4), cuando se colocan los abrebocas que se utilizan en perros (imagen 5) o se aprietan demasiado las mordazas para fijar el tubo orotraqueal. En el 70% de los casos reportados con ceguera cortical postanestésica se recuperó la visión.
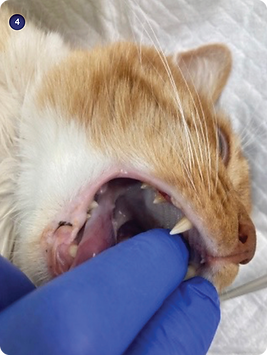
Imagen 4. No abrir completamente la cavidad oral en los gatos.

Imagen 5. No colocar en los gatos los abrebocas que se utilizan en perros.
Conclusiones
Conocer las características anatómicas y fisiológicas, así como las técnicas específicas y las posibles complicaciones durante la anestesia en gatos, ayudará a proporcionar mayor seguridad y disminuir la mortalidad anestésica en esta especie.
Bibliografía
-
Brodbelt D. Perioperative mortality in small animal anaesthesia. Vet J. 2009 Nov;182(2):152-61.
-
Brodbelt DC, Pfeiffer DU, Young LE, Wood JL. Risk factors for anaesthetic-related death in cats: results from the confidential enquiry into perioperative small animal fatalities (CEPSAF). Br J Anaesth. 2007 Nov;99(5):617-23.
-
Rodan I, Dowgray N, Carney HC, Carozza E, Ellis SL, Heath S, Niel L, St Denis K, Taylor S. 2022 AAFP/ISFM Cat Friendly Veterinary Interaction Guidelines: Approach and Handling Techniques. J Feline Med Surg. 2022 Nov; 24(11):1093-1132.
-
Quimby JM, Lorbach SK, Saffire A, et al. Serum concentrations of gabapentin in cats with chronic kidney disease. J Feline Med Surg. Epub ahead of print 23 February 2022.
-
Tucker LE, Sanchez A, Valverde A, Blois S, Uccello O, Rutherford A, Monteith G, Reinhart JM, Keating S, Gu Y, Johnson R. Pharmacokinetic, sedative, and physiological effects of oral compounded formulations of trazodone alone or in combination with gabapentin in male cats. J Vet Pharmacol Ther. 2023 Sep;46(5):300-310.
-
Feline anesthesia and pain management. (2018). Steagall P., Robertson S., Taylor P., Edit. Wiley Blackwell. Pp-40.
-
Rex MA. A review of the structural and functional basis of laryngospasm and a discussion of the nerve pathways involved in the reflex and its clinical significance in man and animals. Br J Anaesth. 1970 Oct;42(10):891-9.
-
Rex MA. Laryngospasm and respiratory changes in the cat produced by mechanical stimulation of the pharynx and respiratory tract: problems of intubation in the cat. Br J Anaesth. 1971 Jan;43(1):54-7.
-
Mitchell SL, McCarthy R, Rudloff E, Pernell RT. Tracheal rupture associated with intubation in cats: 20 cases (1996-1998). J Am Vet Med Assoc. 2000 May 15;216(10):1592-5.
-
Jones TL, Boyer K, Chapman K, Craigen B, da Cunha A, Hofmeister EH. Evaluation of the time to desensitization of the larynx of cats following topical lidocaine application. J Feline Med Surg. 2021 Jun;23(6):563-567. doi: 10.1177/1098612X20967886. Epub 2020 Oct 28.
-
Andress, J.L., Day, T.K., and Day, D. (1995). The effects of consecutive day propofol anesthesia on feline red blood cells. Vet. Surg. 24 (3): 277–282.
-
Baetge, C.L., Smith, L.C., and Azevedo, C.P. (2020). Clinical Heinz body anemia in a cat after repeat propofol administration case report. Front. Vet. Sci. 26 (7): 591556.
-
Pypendop BH, Barter LS, Stanley SD, Ilkiw JE. Hemodynamic effects of dexmedetomidine in isoflurane-anesthetized cats. Vet Anaesth Analg. 2011 Nov;38(6):555-67.
-
Pypendop BH, Ilkiw JE. Assessment of the hemodynamic effects of lidocaine administered IV in isoflurane-anesthetized cats. Am J Vet Res. 2005 Apr;66(4):661-8.
-
Merkel, G. and Eger, E.I. 2nd (1963). A comparative study of halothane and halopropane anesthesia including method for determining equipotency. Anesthesiol. 24: 346–357.
-
Acevedo-Arcique CM, Ibancovichi JA, Chavez JR, Gutierrez-Blanco E, Moran-Muñoz R, Victoria-Mora JM, Tendillo-Cortijo F, Santos-González M, Sanchez-Aparicio P. Lidocaine, dexmedetomidine and their combination reduce isoflurane minimum alveolar concentration in dogs. PLoS One. 2014 Sep 18;9(9).
-
Yamashita K, Iwasaki Y, Umar MA, Itami T. Effect of age on minimum alveolar concentration (MAC) of sevoflurane in dogs. J Vet Med Sci. 2009 Nov;71(11):1509-12.
-
Hammond RA, Alibhai HIK, Walsh KP, et al. Desflurane in the dog; minimum alveolar concentration (MAC) alone and in combination with nitrous oxide. J Vet Anaesth 1994; 21: 21 23.
-
Pypendop, B.H. and Ilkiw, J.E. (2005). The effects of intravenous lidocaine administration on the minimum alveolar concentration of isoflurane in cats. Anaesth. Anlag. 100 (1): 97–101.
-
Barter, L.S., Ilkiw, J.E., Steffey, E.P. et al. (2004). Animal dependence of inhaled anesthetic requirements in cats. Br. J. Anaesth. 92 (2): 275–277.
-
Stiles J, Weil AB, Packer RA, Lantz GC. Post-anesthetic cortical blindness in cats: twenty cases. Vet J. 2012 Aug;193(2):367-73. doi: 10.1016/j.tvjl.2012.01.028. Epub 2012 Feb 29. PMID: 22381708.
-
Barton-Lamb AL, Martin-Flores M, Scrivani PV, Bezuidenhout AJ, Loew E, Erb HN, Ludders JW. Evaluation of maxillary arterial blood flow in anesthetized cats with the mouth closed and open. Vet J. 2013 Jun;196(3):325-31. doi: 10.1016/j.tvjl.2012.12.018. Epub 2013 Feb 8. PMID: 23394845.





