

Año XXI. Edición 125. Septiembre Octubre 2024
Diabetes mellitus insulinorresistente secundaria a acromegalia en un gato
PALABRAS CLAVE: Diabetes mellitus > acromegalia > insulinorresistente > hipersomatotropismo > felino

pMVZ Azarel Paola Chaparro Cazares
Dr. en C. Marco Antonio De Paz Campos²
Dr. en C. Julio Chávez Monteagudo³
-
Alumna de Prácticas profesionales. Hospital de Pequeñas Especies. Facultad de Estudios Superiores Cuautitlán. Universidad Nacional Autónoma de México. UNAM.
-
Farmacología, Analgesia y Medicina Interna. Profesor de Tiempo Completo. Hospital de Pequeñas Especies. Facultad de Estudios Superiores Cuautitlán. Universidad Nacional Autónoma de México. UNAM.
-
Anestesiología, Analgesia y Urgencias. Profesor de Tiempo Completo. Hospital de Pequeñas Especies. Facultad de Estudios Superiores Cuautitlán. Universidad Nacional Autónoma de México. UNAM.
La acromegalia felina (hipersomatotropismo), es un síndrome poco diagnosticado, caracterizado por una secreción hipofisaria excesiva y crónica de la hormona del crecimiento (GH) (Greco, 2012), en gatos adultos. Generalmente afecta a gatos machos de edad avanzada y en la mayoría de ellos es posible identificar un tumor hipofisiario que secreta cantidades elevadas de GH. Este exceso produce una fuerte resistencia a la insulina (Corsini, Niessen, Miceli, et al., 2022). El presente reporte de caso clínico describe el abordaje diagnóstico y terapéutico, así como los hallazgos a la necropsia de un gato macho, esterilizado de 9 años de edad.
Caso clínico
Acude al Hospital de Pequeñas Especies (HPE) de la Facultad de Estudios Superiores Cuautitlán-UNAM, un felino macho, esterilizado, de 9 años de edad; cuyo motivo de consulta es la presentación de diabetes mellitus no controlada, con antecedentes de hiperglucemias que varían de 390 a 490 mg/dl no responsivas a 1 U/kg de insulina con intermedia acción (Humulin N) e hipoglucemiantes vía oral.
Los propietarios reportan la presentación de signos clínicos desde hace 5 meses con poliuria-polidipsia, polifagia y debilidad de miembros pelvianos. Contaba con estudios de hemograma, química sanguínea, urianálisis, prueba de supresión con dexametasona a dosis bajas y perfil tiroideo, descartando Cushing y anormalidades tiroideas.
Al examen físico general las constantes fisiológicas se encuentran dentro de rango normal, con excepción de hallazgos clínicos como linfonodos submandibulares y poplíteos izquierdos reactivos, rasgos faciales amplios (figura 1) con separación anormal de piezas dentales en incisivos (figura 2), debilidad y posición plantígrada de miembros pelvianos, (figura 3). Al examen neurológico presenta disminución de la propiocepción en miembros pelvianos.
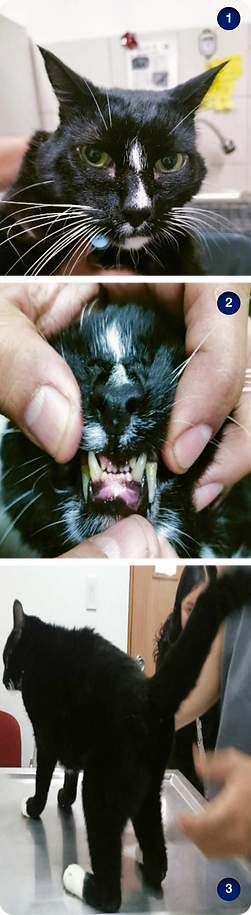
Figura 1. Rostro del paciente en donde se aprecian rasgos faciales amplios y pómulos prominentes.
Figura 2. Incisivos del paciente con separación anormal de las piezas dentales.
Plan Diagnóstico
Se realizan estudios sanguíneos de Hemograma, Química sanguínea y Urianalisis; en el hemograma los hallazgos más relevantes son leucocitosis (26.7 x 10^(9 ) L. Valor de referencia 5.5-19.5) por neutrofilia madura (19.3 x 10^(9 ) L.. Valor de referencia 2.5-12.5) y monocitosis (2.1 x 10^(9 ) L.. Valor de referencia 0.0-0.8). En relación al perfil bioquímico se observa una hiperglucemia (30.8 mmol/L. Valor de referencia 3.8-7.9), hipercolesterolemia (7.7 mmol/L. Valor de referencia,1.8-3.9), hipertrigliceridemia (2.8 mmol/L. Valor de referencia 0.6-1.2), e hiperamilasemia (2381 UI/L. Valor de referencia 600-1100). En el urianalisis colectada por cistocentesis, se observa una densidad urinaria de 1.032, un pH de 6, glucosuria de 3+ (60 mmol/L) proteinuria de 1+ (1.0 g/L) hematuria de 1+ y en el examen microscópico se señalan eritrocitos (10-15/ campo de 400x. Valor de referencia de 0-5 en un campo de 400x) presencia de bacilos 1+ y presencia de escasos cristales de estruvita.
Se realiza estudios de ultrasonido abdominal y estudios radiográficos de columna cervical, toracolumbar y lumbosacra, del mismo modo se realizan estudios de miembros torácicos y pelvianos para descartar artropatías reportadas en los pacientes con acromegalia. La ecografía muestra al bazo con ecogenicidad mixta, una ligera dilatación de la pelvis renal y en ambos riñones se observó cambio en la ecogenicidad, siendo en el riñón izquierdo con cambios hiperecoicos en la médula y en el riñón derecho hiperecogenicidad en la pelvis renal. Los estudios radiográficos muestran alteraciones en la proyección radiográfica medio-lateral de miembro torácico izquierdo de la articulación del codo donde se observa disminución de la densidad ósea en extremo distal del hueso húmero y olécranon de la ulna (figura 4) y en la proyección radiográfica medio-lateral de miembro pelviano izquierdo de la articulación de la rodilla se observa desgaste articular de la rodilla con reacción perióstica (figura 5).

Figura 4. Proyección radiográfica medio-lateral de miembro torácico izquierdo de la articulación del codo. Se observa disminución de la densidad ósea en extremo distal del hueso húmero y olécranon de la ulna.

Figura 5. Proyección radiográfica medio-lateral de miembro pelviano izquierdo de la articulación de la rodilla. Se observa desgaste articular de la rodilla con reacción perióstica.
Figura 3. Posición plantígrada del paciente.

Imagen A: Plano sagital de cráneo donde en la secuencia T2 se observa una lesión en la base de cráneo en la región hipofisiaria de forma ovoide, señalado con las flechas verdes.

Imagen B: Plano transversal de cráneo en donde en la secuencia T2 se aprecia el lado derecho hipofisiario hipertenso y el lado izquierdo hipointenso con un anillo parcial hiperintenso. Señalado por medio de flechas verdes.

Imagen C: Plano sagital de cráneo en donde en la secuencia T1 y con la administración de medio de contraste se presenta un realce heterogéneo señalado con las flechas verdes.
Figura 6. Resonancia Magnética del paciente.
Plan Terapéutico
Se inicia un nuevo tratamiento farmacológico con cabergolina a dosis de 10 mcg/kg cada 48 horas y se continua Insulina humulin 5 UI totales dos veces por día, así mismo se indicó a la propietaria registrar glucemias diarias a la misma hora para observar evolución del paciente. A los 14 días se reajusta la dosis de cabergolina a 10 mcg/kg una vez por día y de insulina glargina a 3 UI totales por nula mejora de glucemias. A los 10 días se vuelve a reajustar la dosis de cabergolina a cada 48 horas debido a que el paciente inició con náuseas, vómitos y dificultad para defecar. A los 15 días se cambia el fármaco cabergolina por octreotida 11.11 mcg/kg una vez por día con insulina glargina 3 UI totales dos veces por día. Durante el tratamiento se realizaron revisiones del paciente donde presentaba animo deprimido intermitente, linfonodos submandibulares y poplíteos izquierdos reactivos, molestia al defecar, poliuria-polidipsia, neuropatía diabética, polifagia, y con las características físicas de rasgos faciales amplios.
El ultimo tratamiento con octreotide duró 20 días hasta que la tutora optó por practicar la eutanasia debido a la poca respuesta de glucemias por parte del paciente.
En la gráfica 1 se observa por medio de una curva las oscilaciones de glucosa que presentó el paciente durante todo el tratamiento.
Gráfica 1. Curva de glucemias del paciente.

Necropsia
Se encontraron diversas lesiones relevantes para el curso de la enfermedad como son a la inspección externa la cabeza ancha con pómulos prominentes. En el sistema musculo esquelético la articulación de la rodilla izquierda se encontró aumentada de tamaño en comparación con la articulación derecha, tanto la capsula articular como los cóndilos articulares del fémur y la superficie articular se observó rugosa y ligeramente grisácea, siendo más grande que del lado contrario, las masas musculares del miembro pelviano izquierdo presentaron menor volumen que el derecho. En el sistema nervioso al extraer el encéfalo se observaron los huesos muy prominentes hacia el interior del cráneo (figura 7). Los diagnósticos morfológicos de la necropsia son hiperplasia linfoide unilateral severa, pancreatitis leve, artrosis unilateral izquierda moderada, atrofia muscular unilateral izquierda moderada y organomegalia en bazo (figura 8), hígado (figura 9) y páncreas.

Figura 7. Cráneo del paciente con tracción del encéfalo. Se observa prominencia de los huesos al interior.
Figura 8. Lengua con tráquea y pulmones de lado izquierdo, del lado derecho el órgano bazo esta aumentado de tamaño.
Figura 9. Hígado aumentado de tamaño con bordes redondeados de coloración negruzca
Histopatología
Se manda a estudio histopatológico cerebro con hipófisis seccionada. El diagnóstico morfológico es adenoma acidófilo de adenohipófisis y encefalomalacia difusa severa.
Discusión
La acromegalia deriva del griego “akron” (extremidad) y “megale” (grande) que hace referencia al característico crecimiento excesivo de los tejidos conectivos, vísceras y huesos del cuerpo (Greco, 2012). De acuerdo con Niessen, Church y Forcada, 2013, el Hipersomatotropismo se refiere al estado de producción excesiva de la hormona de crecimiento, mientras que la Acromegalia es el nombre del síndrome que resulta de ese estado de producción excesiva de la GH. La acromegalia es causada por un adenoma acidofílico, ubicado en la adenohipófisis, el cual produce una sobreexpresión generalizada de los tejidos a GH e IGF-1 (Nelson y Couto, 2010, y Melián, Pérez, Peterson, Díaz y Kooistra, 2008).
Los factores predisponentes ocurren en gatos machos, mayores de 8 años de edad. Y los signos clínicos comunes son: hiperglucemia no controlada, por lo que incluye signos de poliuria-polidipsia y polifagia; aumento de rasgos faciales, aumento de los espacios interdentales, organomegalia, ganancia de peso, alteraciones cardiacas como la presencia de soplos, y signo de polineuropatia (Greco, 2012 y Nelson y Couto, 2010). Dichos signos se cumplen en el caso clínico presentado a excepción de alteraciones cardiacas.
Los signos clínicos clásicos de la acromegalia son el resultado de los efectos catabólicos como anabólicos de la GH y en algunos casos, el efecto adicional de un tumor hipofisiario que se expande gradualmente (Niessen, 2010). Los efectos que estimulan el crecimiento de IGF-1 resultan en la proliferación de huesos, cartílagos, tejidos blandos y organomegalia, signos característicos de la enfermedad (Nelson y Couto, 2010). La artropatía acromegálica es causada por la inducción de hiperplasia e hipertrofia del cartílago por parte del IGF-1, lo que conduce a una alteración de la geometría de las articulaciones y del metabolismo de los condrocitos (Greco,2012). La polineuropatia generalmente resulta del atrapamiento de los nervios en el tejido hipertrofiado y también se puede observar neuropatía diabética debido a una mala regulación diabética de acuerdo con Corsini, Niessen, Miceli, et al., 2022.
Para Greco,2012, la hiperglucemia es causado debido a que el metabolismo de la glucosa es afectado por la GH como por la IGF-1. La GH tiene una acción directa sobre los islotes pancreáticos al aumentar la capacidad secretora de las células beta causando una hiperplasia de las células beta, al ser un hipersomatotropismo prolongado se excede la capacidad secretora de insulina y provoca diabetes mellitus. La insulinorresistencia resulta de una disminución de los receptores de insulina, un aumento de la unión del receptor de insulina y antagonismo post-receptor.
De acuerdo con Scudder y Church, 2024, la GH antagoniza la insulina al reducir la captación muscular de glucosa, disminuye la oxidación de la glucosa y aumenta la gluconeogénesis. La GH también estimula una mayor secreción de IGF-1 y al existir un alto grado de homología de secuencia entre el receptor de insulina y los receptores IGF-1 permite que la insulina y el IGF-1 activen los receptores de cada uno, sin embargo, el IGF-1 solo tiene el 10% de la potencia de activación en el receptor de insulina. Se debe de tomar en cuenta que la relación entre GH e IGF-1 no es lineal, y dado que las proteínas de unión a IGF-1 también afectan la disponibilidad de IGF-1 para activar el receptor de insulina, es probable que el efecto sobre la homeostasis glucémica tenga una alta variabilidad interindividual, lo que resulta al final en todos los casos en resistencia a la insulina.
De acuerdo con Miceli, García y Pompili, et al., 2022, estiman que entre el 17.8 y el 24.8% de los gatos diabéticos que investigaron en Europa (Suiza, Países Bajos y Reino Unido) son en consecuencia de un exceso de GH, a diferencia de Scudder y Church, 2024 ya que para ellos casi todos los gatos diagnosticados con hipersomatotropismo llegan a tener diabetes mellitus concurrente, y algunos llegan a progresar aún más a una resistencia extrema a la insulina.
Para el plan diagnóstico es importante descartar hiperadrenocorticismo e hipertiroidismo con los estudios de cortisol bajo supresión con dexametasona y perfil tiroideo, debido a que ambas patologías se relacionan con hiperglucemias resistentes a la insulina y en el caso de hiperadrenocorticismo, con la presencia de tumor a nivel de la hipófisis (Miceli, García, Rey Amonategui., et al., 2023). En el presente caso clínico se descarta hiperadrenocorticismo e hipertiroidismo.
Se realizan estudios radiográficos de columna, miembros torácicos y pelvianos ya que se han encontrado artropatías degenerativas con hallazgos de reacciones periósticas periarticulares y osteofitos, inflamación de los tejidos blandos y colapso del espacio articular. También se ha observado en proyecciones torácicas signos de cardiomegalia, edema pulmonar, perihiliar y/o derrame pleural (Greco, 2012). En el caso clínico no se encontraron alteraciones en corazón o tórax, pero los hallazgos que si se encontraron fueron alteraciones óseas y articulares descritas anteriormente.
En la ecografía, los hallazgos de dilatación de la pelvis renal, así como la hiperecogenicidad de la médula renal son un sugerente de pielonefritis, como resultado de infecciones crónicas o bien por diuresis incrementada (Nyland, 2016).
Para el plan diagnóstico, el estudio de Factor de Crecimiento Similar a la insulina es el estudio inicial, ya que el aumento de IGF-1 sérico normalmente coincide con el desarrollo y el crecimiento del adenoma hipofisiario somatotrópico (Nelson y Couto, 2010). Niessen, Church y Forcada, 2013 menciona que es positivo a partir de 1000 ng/ml. Sin embargo, de acuerdo con por Corsini, Niessen, Miceli, et al., 2022, no es 100% certero debido a que, se requieren imágenes confirmatorias de la presencia del tumor ya que está asociado con un valor predictivo del 95 % y un valor predictivo negativo del 91%, por la consideración de que la administración exógena de insulina pudiera influir en la inhibición de IGF-1 (Niessen, Church y Forcada, 2013).
La resonancia magnética es el estudio de imagen ideal al ser más sensible que la tomografía axial y al requerir un medio de contraste para evidenciar la presencia del tumor adenohipofisiario, según Greco, 2012 y Niessen, Church y Forcada, 2013.
Es importante mencionar que la presencia de agrandamiento o neoplasia hipofisiaria afecta a menos del 2% de los gatos y que si el paciente tiene una concentración de IGF-1 >700 ng/ml y demuestra un agrandamiento de la hipófisis, es altamente sugestivo de acromegalia felina, según Scudder y Church, 2024. En el presente caso se cumplen con ambos criterios al tener una concentración de IGF-1 de 2983 ng/ml, y al confirmar un adenoma hipofisario por la resonancia magnética.
El paciente estuvo inicialmente antes, de llegar a consulta con tratamiento de hipoglucemiantes gibenclamida y glipizida, sin embargo, no hay pruebas convincentes que respalden su uso en gatos. En relación de la administración de insulina exógena, la insulina humulin es una insulina de acción rápida-intermedia con una duración aproximada de 8 – 12 horas, por lo que decidimos cambiar a insulina glargina, que es la que se recomienda cuando las glucemias son persistentes porque entra en la clasificación de análogo de insulina de acción más prolongada con una duración de 12 -24 horas (Sparkers, Canon, Church, et al., 2015).
El plan terapéutico a seguir fue el tratamiento médico, aunque de acuerdo con Greco, 2012 la hipofisectomía transesfenoidal es el estándar de oro para el tratamiento de humanos porque proporciona reducciones rápidas y completas de las concentraciones séricas de GH e IGF -1 que conducen a la resolución de la resistencia a la insulina, lo cual coincide con Slingerland, et al., 2008, donde él también considera que la cirugía debe de ser la primera opción para los microadenomas; según Fleeman y Gostelow, 2020, como ventaja se elimina el tumor y se normaliza la IGF-1, sin embargo la desventaja es la disponibilidad limitada, el costo, el reemplazo hormonal requerido a largo plazo, y la mortalidad asociada a la experiencia del cirujano, así como de los cuidados posoperatorios intensivos de alta calidad (Fleeman y Gostelow, 2020 y Niessen, Church y Forcada, 2013), El tratamiento por radioterapia no se consideró porque está poco disponible en el país, requiere sesiones constantes, hospitalización prolongada, lenta tasa de reducción del tumor, en ocasiones no se normaliza la GH y posibilidad de recaída, conforme a Fleeman y Gostelow, 2020 y Slingerland, et al., 2008.
Es por lo anterior que se optó por el tratamiento terapéutico, el cual de forma inicial fue optar con administración de carbegolina a 10 mcg/kg cada 48 horas, ya que al ser agonista de dopamina de acción prolongada con alta afinidad de receptor de dopamina tipo 2 causa inhibición de la liberación hipofisiaria de GH, además que es ampliamente disponible en el mercado y es de bajo costo de acuerdo con Miceli, García y Pompili, et al., 2022 y Fleeman y Gostelow, 2020. También se cambió el uso de insulina a glargina por ser la insulina de acción más prolongada, y se instauró una dieta baja en carbohidratos. El paciente estuvo un mes con el tratamiento descrito, con redosificaciones de cabergolina, sin embargo, no se obtuvo la respuesta esperada de baja de glucemia, lo anterior coincide con lo que menciona Scudder y Church, 2024, en donde han observado que la respuesta a la cabergolina en gatos con acromegalia ha sido, en el mejor de los casos, variable, y esto podría deberse a que muchos gatos tratados tienen un hipersomatotropismo que es demasiado grave para responder a este tratamiento. Un estudio realizado en el Reino Unido que utilizó una dosis de cabergolina de 10 mcg/kg cada 24 horas no informó ninguna mejora en las concentraciones de IGF-1 o control diabético en ocho gatos que completaron el período de tratamiento de 90 días; en otro segundo estudio en Argentina informaron la remisión diabética en 8/22 gatos que completaron 6 meses de tratamiento, en donde el IGF-1 se normalizó en 6/23 gatos, siendo aquellos con masas hipofisarias más pequeñas los que tenían más probabilidades de lograr el control de IGF-1, por lo que se puede relacionar que la mayor probabilidad de respuesta a la cabergolina es en pacientes con masas hipofisarias más pequeñas porque la expresión del receptor 2 de dopamina disminuye a medida que aumenta el tamaño de la masa pituitaria.
Se decide cambiar de tratamiento a ahora un análogo de la somatostania que es el octreotide a 11.11 mcg/kg dos veces al día, en donde se obtuvo una mejor respuesta de glucemias, sin embargo, se estuvo menos de un mes de tratamiento debido a la decisión del tutor.
Greco, 2012, menciona que el octreotido ha demostrado fracasos de leves a moderados, debido a que los análogos de somatostatina tienen receptores específicos por especie.
En la necropsia, se encontraron alteraciones macroscópicas que coinciden nuevamente con los signos de acromegalia felina como son a la inspección externa la cabeza ancha con pómulos prominentes y en el sistema nervioso al extraer el encéfalo se observaron los huesos muy prominentes hacia el interior del cráneo, lo que coincide con las características físicas antes mencionadas por efecto anabólico de la secreción pulsátil de la GH (Greco, 2012); el páncreas aumentado de tamaño, al igual que el hígado que presentaba bordes redondeados y la esplenomegalia se relaciona con organomegalia causado por el efecto anabólico de la GH. En el sistema musculo esquelético la articulación de la rodilla izquierda y los cambios reportados pueden ser causa de hiperplasia e hipertrofia del cartílago (Nelson y Couto, 2010).
La histopatología del cerebro determinó adenoma acidófilo de adenohipófisis y encefalomalacia difusa severo, lo cual confirma el diagnóstico de acromegalia felina, correlacionado con Miller, Piotrowski, Donovan, et al., 2021, donde describen que la producción de GH por parte de un adenoma somatotropo es la causa más habitual del hipersomatotropismo felino.
Se debe considerar que se tuvieron varias complicaciones en el estudio, como son el poco tiempo que estuvo el paciente con cada tratamiento médico de cabergolina y octreotide, así como las tomas de muestras que no fueron diarias y a la misma hora y el contar con un registro con espacios vacíos donde no se sabe si seguía con tratamiento o se daban descansos de tratamiento y de insulina.
Conclusiones
En todos los pacientes felinos con diabetes mellitus insulinorresistente se debe de considerar como una causa la acromegalia, lo que conduce al médico a realizar estudios para confirmar la sospecha incluyendo el IGF-1 y en caso de estar aumentado se justifica plenamente la resonancia magnética.
Con respecto al tratamiento la mejor opción es quirúrgica, sin embargo, su disponibilidad en el país es escasa y costosa, la radioterapia no es completamente efectiva en todos los pacientes y puede producir efectos no deseados, mientras que el tratamiento médico no ha mostrado éxito pleno en la mayoría de los casos, por lo tanto, se considera todo un desafío el tratamiento exitoso de estos casos.
Bibliografía:
-
Corsini A., Niessen S. J., Miceli D. D., et al. (2022). Quality of life and response to treatment in cats with hypersomatotropism: the owners' point of view. Journal of Feline Medicine and Surgery, 24 (8) 175-182. DOI: 10.1177/1098612X221098718
-
Fleeman L. y Gostelow R. (2020). Updates in Feline Diabetes Mellitus and Hypersomatotropism. ELSEVIER, Vet Clin North Small Anim, 50 (5) 1085-1105. DOI: 10.1016/j.cvsm.2020.06.005
-
Greco D. S. (2012). Feline Acromegaly. ELSEVIER, Anim Med., 27 (1). 31-35. DOI: 10.1053/J.TCAM.2012.05.004.
-
Henson S. M. y O´Brien D. T. (2006). Feline models of type 2 Diabetes Mellitus. ILAR Journal, 47 (3) 234-242. DOI: 10.1093/ilar.47.3.234
-
Hurty C. A. y Flatland B. (2005). Feline acromegaly: a review of the syndome. Journal of the American Animal Hospital Association ,41 (5) 292-297. DOI: 10.5326/0410292
-
Melián C., Pérez M., Peterson M., Díaz M. y Kooistra H. (2008) Manual de endocrinología de pequeños animales. Multimedia Ediciones Veterinarias, Barcelona, España.
-
Miceli D.D, García J.D, Rey Amonategui J.P., et al. (2023). Prevalence of hypersomatotropism and hyperthyroidism in cats with diabetes mellitus from referral centers in Buenos Aires (2020-2022). Journal of Feline Medicine and Surgery, 25 (2). DOI: 10.1177/1098612X221148565.
-
Miceli D. D., García J. D. Pompili G.A., et al. (2022). Cabergoline treatment in cats with diabetes mellitus and hypersomatotropism. Jorunal of Feline Medicine and Surgery, 24 (12) 1238-1244. DOI: 10.1177/1098612X221074924
-
Miller M. A. Piotrowski S. L., Donovan T.A, et al. (2021). Feline Pituitary Adenomas: Correlation of Histologic and Immunohistochemical Characteristics With Clinical Findings and Case Outcome. Vet Pathol, 58 (2) 266-275. DOI: 10.1177/0300985820978309.
-
Nelson R. W. y Couto C. G. (2010). Medicina Interna de Pequeños Animales. ELSEVIER, Barcelona, España.
-
Niessen S. J. (2010). Feline acromegaly: an essential differential diagnosis for the difficult diabetic. ELSEVIER, Journal of Feline Medicine and Surgery,12 (1) 15-23. DOI: 10.1016/j.jfms.2009.12.003
-
Niessen S. J., Church D. B. y Forcada Y. (2013). Hypersomatotropism, Acromegaly, and Hyperadrenocorticism and Feline Diabetes Mellitus. ELSEVIER, Vet Clin North Small Anim, 43 (2) 319-350. DOI: 10.1016/j.cvsm.2012.12.004
-
Nyland T. (2016) Diagnostico Ecografico de pequeños animales. Multimedia Ediciones Veterinarias. España.
-
Rand J. S. (2005). Diabetes Mellitus in Cats. ELSEVIER, Vet Clin Small Anim, 35 (2005) 211-224. DOI: 10.1016/j.cvsm.2004.10.001
-
Scudder C. y Church D. (2024). Feline Comorbidities: Hypersomatotropism-induced diabetes in cats. Journal Feline Medicine and Surgery, 26 (2). DOI: 10.1177/1098612X241226690
-
Slingerland L. I., et al. (2008). Growth hormone excess and the effect of octreotide in cats with diabetes mellitus. ELSEVIER, Domestic Animal Endocrinology, 35 (2008), 352-361. DOI: 10.1016/j.domaniend.2008.07.004
-
Sparkes A., Cañón M., Church D., et al. (2015). Consensus Guidelines on the Practical Management of Diabetes Mellitus in Cats. Journal of Feline Medicine and Surgery, 17 (3) 235-250. DOI: 10.1177/1098612X15571880





