

Año XXII. Edición 128. Abril Mayo 2025
Informe de caso: Diagnóstico y tratamiento con análogo de nucleósido GS-441524 en un gato con peritonitis infecciosa felina
PALABRAS CLAVE: Nucleósido GS-441524 > peritonitis infecciosa felina > efusión peritoneal > diarrea
MVZ Priscila Estefanía Buestán Sarmiento¹
MVZ Esp. MMVZ Octavio Mejía Ponce²
-
Programa de residencia especialidad, Hospital Veterinario de Especialidades UNAM
-
Responsable del Consultorio de Dermatología, Hospital Veterinario de Especialidades UNAM
Caso clínico
Se recibe en el Hospital Veterinario de Especialidades UNAM (HVE UNAM) un gato doméstico de pelo corto, hembra esterilizada de 1 año 4 meses de edad, con diagnóstico presuntivo de peritonitis infecciosa felina.
Previamente, la paciente estuvo hospitalizada (externamente) por presentar hiporexia, pérdida de peso, diarrea escala Bristol 6/7 y abdomen pendulante por efusión peritoneal. Tres meses previos a presentar los signos clínicos, la paciente fue esterilizada.

Durante su hospitalización, realizaron estudio por inmunocromatografía triple entérica (positiva a coronavirus), inmunocromatografía VIF/VLeF (negativa), estudio citológico de efusión peritoneal, hemograma (tabla 1) y bioquímica sanguínea (tabla 2), en donde se reportó anemia normocítica normocrómica (asociada a proceso inflamatorio crónico), leucocitosis y monocitosis por neutrofilia asociadas a inflamación crónica, trombocitopenia asociada a probable aumento en su utilización o a destrucción, eosinofilia asociada a probable parasitosis y linfocitosis asociada a estímulo antigénico; así como hipoproteinemia por hipoalbuminemia (globulinas dentro de rango), con relación albúmina/ globulina (A/G) disminuida (asociadas a inflamación crónica y salida a terceros espacios), hipocalcemia por hipoalbuminemia y, por último, hiperglucemia transitoria.
La efusión peritoneal fue de color amarillo, aspecto turbio, densidad 1.018, con solidos totales 25 g/L, proteínas totales: 24 g/L, albumina: 8 g/L, globulinas: 16 g/L, relación A/G: 0.5 g/L, conteo celular: 5.7x109/L y celularidad con predominio de neutrófilos bien conservados (87%), linfocitos maduros (9%) y macrofagos activos (4%). Las alteraciones en el estudio citológico se interpretaron como trasudado modificado.
A los 3 días realizaron hemograma control (tabla 3) en el que se reportó: anemia severa normocítica normocrómica regenerativa (por inflamación crónica), leucocitosis por neutrofilia con desviación a la izquierda asociada a inflamación crónica activa, trombocitopenia asociada a probable aumento en su utilización o su destrucción y linfocitosis por estimulación antigénica o proceso linfoproliferativo.
Tabla-1
Tabla 1. Hemograma externo
Tabla-2
Tabla 2. Química sanguínea externa
Tabla-3
Tabla 3. Hemograma Control
Posterior a su alta, acudió al HVE UNAM. En el examen físico general (EFG) se reportó condición corporal 1/5, peso 2.17 kg, membranas mucosas pálidas, taquipnea, disminución de sonidos respiratorios, desdoblamiento de sonido cardiaco, abdomen pendulante, temperatura 37.9 º C y score muscular D.
Se procedió a realizar:
●TFAST (figs.1,2,3) (thoracic focused assessment with sonography for trauma, triage and tracking), AFAST (figs. 4,5,6) (abdominal focused assessment with sonography for trauma, triage and tracking), en los que se observó efusión peritoneal (no se reportó en qué punto), de manera incidental se identificó lesión hipoecoica en hígado de 1.6 x 1.4 cm, venas hepáticas dilatadas y efusión pleural y pericárdico, respectivamente.

Imagen 1.
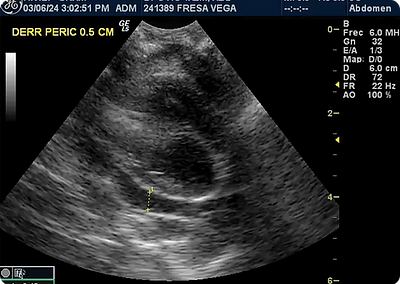
Imagen 3.

Imagen 5.
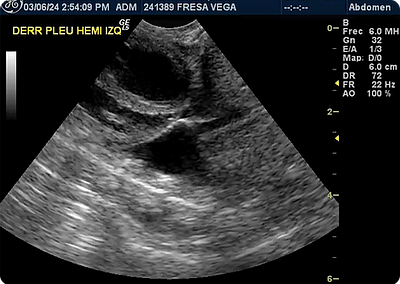
Imagen 2.

Imagen 4.

Imagen 6.
●Estudio radiográfico de silueta cardiaca (figs. 7,8) en sus proyecciones Li- Ld y DV en las que se observó signos de donas y vías de tren, asociados a patrón bronquial, broncogramas aéreos asociados a patrón alveolar y signo de silueta cardiaca parcial, en región ventral, asociado a efusión pleural y efusión pericárdica, desplazamiento dorsal de la tráquea, probablemente asociado a posición de la paciente y de manera incidental se observó incremento de la densidad en abdomen debido a la presencia de efusión peritoneal.
●Estudio por inmunocromatografía VIF/LeVF que fue negativa.
●Medición de presión arterial sistémica (PAS) de 118/79 (94), lo que se interpretó como paciente normotenso.
●Hematocrito el cual estuvo en 0.14 L/L.
Hemograma (Tabla 4) en el que se reportó anemia normocítica normocrómica (en esta ocasión, se observaron signos de regeneración) asociada a probables pérdidas. Morfología eritrocítica con anisocitosis 2+, policromasia 1+, excentrocitos 3+, picnocitos 3+, fragmentocitos 3+, acantocitos 3+ y eritrocitos nucleados 2/100 leuc, asociada a daño mecánico y oxidativo. Trombocitopenia por macroplaquetas (1+) y agregados plaquetarios 2+. Leucocitosis por neutrofilia con desviación a la izquierda, neutrófilos tóxicos 1+ y monocitosis asociadas a reacción leucemoide por inflamación crónica activa.
Tabla-4
Tabla 4. Hemograma Control

Imagen 7.
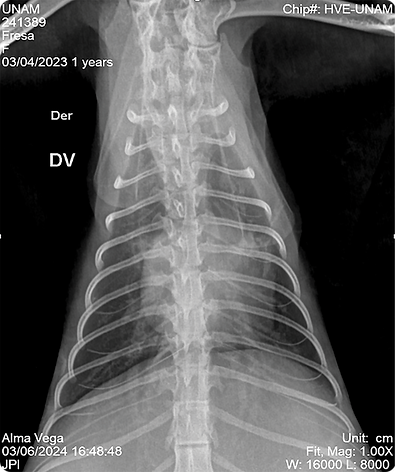
Imagen 8.
●En la bioquímica sanguínea (tabla 5) se observó hipoglucemia asociada a consumo in vitro, hipocreatinemia asociada a la condición corporal, hiperbilirrubinemia por incremento de bilirrubina conjugada y bilirrubina no conjugada asociada a probable colestasis, sin descartar hemólisis de origen inmunomediado. Hipoalbuminemia e hiperglobulinemia con relación A/G disminuida asociadas a inflamación y salida a terceros espacios.
Tabla-5
Tabla 5. Química sanguínea, día 1 de evolución
Tabla-6
Tabla 6. Hemograma, día 5 de evolución
El diagnóstico presuntivo fue peritonitis infecciosa felina (PIF), sin descartar presencia conjunta de Mycoplasma, por lo que se envió tratamiento a casa con prednisolona 0.5 mg/kg vía oral (PO), c/ 12 horas (BID) por 3 días; posteriormente, 1 mg/kg PO BID hasta nueva indicación (HNI) y doxiciclina 5 mg/kg PO BID durante 21 días. Se propuso realizar transfusión sanguínea, pero fue declinada por los turores.
El día 5, se reportó diarrea escala Bristol 5/7, pérdida de peso de 2.17 kg a 1.9 kg. Se realizó AFAST control, en donde se observó efusión peritoneal en punto cistocólico, no puncionable y hemograma control (tabla 6) en donde se observó anemia normocítica normocrómica con escasos signos de regeneración asociada a inflamación crónica, trombocitopenia asociado a agregados plaquetarios, leucocitosis por neutrofilia con desviación a la izquierda y linfopenia asociada a glucocorticoides endógenos. Se decidió continuar con tratamiento con prednisolona a 2 mg/ kg PO BID y doxiciclina a 5 mg/kg PO BID.
El día 12, subió de peso a 1.8 kg. Se observó adelgazamiento y eritema generalizado en piel y lesiones ulceradas en dorso, región cervical dorsal y borde caudal de la escápula. Se realizó AFAST y TFAST en donde no hubo alteraciones y citología de las lesiones en las que se observó neutrófilos degenerados 1+, macrófagos 1+, eosinófilos y linfocitos escasos, el raspado fue negativo. Se indicó reducir dosis de prednisolona a 1.5 mg/kg PO BID durante 7 días, posteriormente 1 mg/kg PO BID durante 7 días y, finalmente, 1 mg/kg PO SID cada 48 horas en tres ocasiones. Dichas lesiones pudieron asociarse a vasculitis secundaria a PIF. Se indicó continuar con doxiciclina hasta completar tratamiento y realizar baños localizados de las lesiones con shampoo a base de clorhexidina.
El día 18 continuó con diarrea escala Bristol 4/7; en el EFG se observó mejoría en la condición corporal de 1/5 a 2/5, score muscular de D a C, e incremento de peso de 1.8 kg a 2 kg. Las lesiones dermatológicas mejoraron. En esta visita se realizó examen oftalmológico en donde se observó fibrina en cámara anterior de ojo derecho, la producción de lágrima fue de 19 mm/min en ojo derecho y de 16 mm/min en ojo izquierdo y no se observaron alteraciones asociadas a uveítis, también se realizó examen dermatológico en el que no hubo alteraciones. El plan fue continuar con reducción de prednisolona y suspender los baños con clorhexidina.
La paciente continuó presentando diarrea escala Bristol 5/7 para el día 26; no se reportaron alteraciones en el EFG, el peso se encontró en 2.1 kg, su score muscular se mantuvo en C y las lesiones en piel repararon. La tutora, estudiante de medicina veterinaria y zootecnia, inició tratamiento con análogo de nucleósido GS-441524 por vía subcutánea (SC) a dosis de 6 mg/kg.
Para el día 75, la paciente lleva 45 días con la administración de GS-441524. Con el, reportaron gran mejoría, ya que subió de peso a 2.9 kg, mejoró su consumo de alimento y su score muscular pasó de C a B. Continuó con diarrea escala Bristol 4/7.
Se realizó AFATS y TFAST, hemograma, química sanguínea y urianálisis (DU 1.050) en los que no hubo alteraciones relevantes.
La paciente acudió el día 122, no presentó alteraciones en el EFG y ya no recibía ningún tratamiento (se dejó de administrar el GS-441524 el día 80 de tratamiento). En esta visita, su condición corporal, score muscular y peso mejoraron reportándose en 3/5, B y 3.4 kg, respectivamente. Se realizó hemograma, química sanguínea y urianálisis (DU 1.052) control sin alteraciones relevantes. La paciente se mantiene estable hasta el día de hoy.
Discusión
La PIF fue descrita por primera vez en 1963, por la Dra Jean Holzworth y sus colegas del Hospital Angell Memorial Animal, en Boston, y se ha estimado que alrededor del 0.3 al 1.4% de las muertes felinas en hospitales veterinarios son causadas por PIF. (1,2) Está enfermedad viral ocurre principalmente en gatos domésticos menores de 2 años de edad de cualquier raza y, al parecer, machos no esterilizados están sobrerrepresentados. En un estudio retrospectivo, realizado en la universidad Ludwing de Munich, la mayoría de los gatos con PIF fueron europeo doméstico de pelo corto, de entre 6 meses y 2 años, (3,4,5) rango de edad y raza a los que pertenece la paciente de este caso.
El coronavirus felino (FCoV) es el agente causal de la PIF. Este virus de ARN, tiene una alta tasa de mutación, lo que facilita el cambio del tropismo celular de FCoV entérico menos virulento a un FCoV asociado a PIF. (1,3,4,6)
Además de la mutación, se proponen factores predisponentes propios del huésped, como características genéticas, edad, enfermedad concurrente, la diversidad del complejo mayor de histocompatibilidad (MHC), la producción de citocinas, la apoptosis de linfocitos, factores ambientales (albergues, criaderos) y factores estresantes (esterilización, introducción de un nuevo gato, hacinamiento). (4,7) Dentro de la historia clínica de la paciente existió un evento de estrés (esterilización), lo que probablemente desencadenó la mutación del virus, ya que posterior a esto presentó hiporexia, pérdida de peso, diarrea y abdomen pendulante.
Los signos clínicos de la PIF son inespecíficos y dependen de la distribución de la vasculitis y de las lesiones piogranulomatosas; ambas, cosntituyen los eventos patológicos rectores de la enfermedad. Se describen dos presentaciones: la forma efusiva y la forma no efusiva (seca). Tanto en PIF efusiva como no efusiva se observan signos como anorexia, pérdida de peso, retraso en el crecimiento, letargo, fiebre fluctuante (que generalmente no responde a medicamentos), signos gastrointestinales y en ocasiones ictericia (más común en PIF efusiva). La PIF no efusiva se asocia con signos neurológicos, oculares y dermatológicos.(3,8)
Las efusiones son más comunes en abdomen, pero también las puede haber en pleuras, pericárdio y, rara vez, escroto. En un estudio de 224 gatos el 78% de los gatos tenían efusión y en otro estudio de 127 gatos la efusión se presentó en el 86%. (1)
Durante la palpación se puede identificar masas, linfonodos mesentéricos agrandados, irregularidades en riñones e hígado, renomegalia y hepatomegalia. (3,8) En la paciente, además de los signos anteriormente mencionados, se identificaron lesiones en piel, asociadas probablemente a síndrome de fragilidad cutánea secundaria a vasculitis por PIF. En el examen oftalmológico no se observaron alteraciones asociadas a uveítis, pese a ello, no se descarta que en algún momento la haya presentado.
El diagnóstico definitivo se basa en el estudio histopatológico con inmunohistoquímica que revela el antígeno FCOV, pero, en ausencia de ese estudio, se puede obtener un alto grado de sospecha (7) empleando algoritmos para el diagnóstico, los cuales consideran historia clínica, signos clínicos y EFG, para seleccionar las pruebas diagnósticas necesarias y así construir el diagnóstico “ladrillo por ladrillo”. (1)
En la bioquímica sanguínea como en el hemograma se reportan alteraciones como: anemia no regenerativa normocítica, normocrómica -leve a moderada-, microcitosis, linfopenia, neutrofilia (en ocasiones con desviación a la izquierda), aumento de la proteína sérica total, hiperglobulinemia, hipoalbuminemia, disminución de la relación albúmina:globulina (<0.4), -se sugiere que una relación A:G >0.8 se considera inconsistente con PIF-, hiperbilirrubinemia en ausencia de hemólisis sin incremento de enzimas hepáticas, valores altos de amiloide sérico A (SAA) y de glicoproteína ácida α-1 (AGP) >1.5mg/ml. (1,3,8). Las lateraciones en la bioquímica y el hemograma se presentaron en la paciente de este caso.
Las efusiones de PIF generalmente tienen alto nivel de proteínas, con una concentración total superior a 35 g/L y una relación A:G <0.4.
El recuento celular es variable, pudiendo ser bajo, es decir, <5x109/L, o alcanzar un recuento de 20x109/L o incluso más.
La inflamación generalmente es piogranulomatosa, representada por macrófagos, neutrófilos no degenerados y pocos linfocitos. (1,3) En la paciente, el resultado no fue exudado aséptico, que es lo más común en esta enfermedad, sin embargo, las características de las efusiones en PIF, dependerán de la concentración de proteínas totales y del recuento celular, pudiendo también presentarse trasudados modificados en PIF como en este caso.
Los estudios de imagen identifican presencia de efusiones y alteraciones en tejidos blandos. En la paciente, se identificó efusión peritoneal, pleural y pericárdica, y de manera incidental se observó una lesión en hígado que podría corresponder a la formación de piogranulomas. (3,8)
Existen otros estudios que detectan el ARN de FCoV mediante reacción en cadena de polimerasa de transcriptasa inversa (RT-PCR), pero esta no diferencia definitivamente entre las formas mutadas y no mutadas de FCOV. La prueba de Rivalta identifica exudados inflamatorios proteicos, sin embargo es muy subjetiva y un resultado negativo no descarta PIF. Todos estos métodos de detección tanto indirectos como directos solo indican la presencia de FCoV y no el virus mutado asociado a PIF. (1)
En la actualidad, el tratamiento dirigido a la replicación del FCoV con compuestos que contienen GS-441524, es muy prometedor, ya que se han reportado tasas de éxito de 81% al 100%. Es importante tener en cuenta que el medicamento no está disponible legalmente para uso en animales (de hecho, la Administración de Alimentos y Medicamentos de Estados Unidos - FDA por sus siglas en inglés- tampoco autoriza este medicamento para uso veterinario). (9)
En un inicio este medicamento se administró de manera subcutánea (SC), pero actualmente existen preparaciones orales (PO) que reportan igual efectividad. (3) El tiempo y dosis de administración no está claro, la mayoría de los estudios han utilizado cursos de tratamiento de 84 días, pero se ha publicado que cursos más cortos, de 42 días, también son efectivos. Respecto a la dosis, existe gran variabilidad y según estudios, dependerá de la presentación de la enfermedad; pueden ir desde 2 mg/kg hasta 20 mg/kg cada 24 horas, ya sea PO o SC. (2)
El análogo de nucleósido GS-441524, es el principal metabolito del profármaco antiviral remdesivir y molnupiravir, entre otros. Este medicamento inhibe la replicación del ARN viral al ingresar a la célula como monofosfato GS-441524 para posteriormente biotransformarse en trifosfato GS-441524, un inhibidor análogo de ribonucleótido de la ARN polimerasa viral. (10, 11)
Existen varios estudios que reportan el uso de este medicamento en gatos con PIF, en los cuales mencionan resultados favorables, ya que observan mejoría significativa; sin embargo, el fármaco se encuentran en fase de experimentación. En la paciente de este caso, hasta el momento el análogo de nucleósido no a generado efectos adversos (ALT, linfocitosis y eosinofilia) (12) y al parecer la frecuencia y dosis administrada fue eficiente, ya que ha logrado la remisión de los signos clínicos.
Conclusión
La peritonitis infecciosa felina es una enfermedad infecciosa de etiología viral, que ocurre principalmente en gatos domésticos, generalmente menores de 2 años, de cualquier raza y que, al parecer, los machos no esterilizados están sobre representados.
Los signos se desarrollan debido a una respuesta inmunológica a la actividad del virus. Éstos se asocian a una presentación húmeda, la cual cursa con derrame torácico o abdominal. El líquido suele corresponder a un exudado aséptico, con predominio de neutrófilos. La forma seca se caracteriza por la formación de granulomas en distintos órganos como el riñón o el ojo.
Hasta hace poco se consideraba que no había tratamiento efectivo. Sin embargo, el análogo de nucleósido GS-441424 constituye una alternativa que ha mostrado elevada efectividad en el tratamiento de los gatos infectados.
Existen testimonios positivos de varios estudios experimentales en los que han usado el análogo de nucleósido GS-441524 como en este caso, sin embargo, no existe un medicamento avalado que se pueda usar de manera legal, por lo que su uso se restringe a la responsabilidad del tutor para su adquisición y su administración.
Referencias
-
Thayer V, Gogolski S, Felten S, Hartmann K, Kennedy M, Olah GA. 2022 AAFP/EveryCat Feline Infectious Peritonitis Diagnosis Guidelines. J Feline Med Surg [Internet]. 2022;24(9):905–33. Disponible en: http://dx.doi.org/10.1177/1098612X221118761
-
Pedersen NC, Perron M, Bannasch M, Montgomery E, Murakami E, Liepnieks M, et al. Efficacy and safety of the ncleoside analog GS-441524 for treatment of cats with naturally occurring feline infectious peritonitis. J Feline Med Surg [Internet]. 2019;21(4):271–81. Disponible en:http://dx.doi.org/10.1177/1098612X19825701
-
Mostl K. GUIDELINE for feline infectious peritonitis [Internet]. ABCD cats & vets. ABCD Europe; 2009 [cited 2024 Oct 18]. Disponible en: https://www.abcdcatsvets.org/guideline-for-feline-infectious-peritonitis/
-
Little S. The cat: Clinical medicine and management. Little S, editor. Saunders; 2013.
-
Tsai H-Y, Chueh L-L, Lin C-N, Su B-L. Clinicopathological findings and disease staging of feline infectious peritonitis: 51 cases from 2003 to 2009 in Taiwan. J Feline Med Surg [Internet]. 2011;13(2):74–80. Disponible en: http://dx.doi.org/10.1016/j.jfms.2010.09.014
-
Tasker S. Diagnosis of feline infectious peritonitis: Update on evidence supporting available tests. J Feline Med Surg [Internet]. 2018;20(3):228–43. Disponible en:: http://dx.doi.org/10.1177/1098612X18758592
-
Kennedy MA. Feline infectious peritonitis: Update on pathogenesis, diagnostics, and treatment. Vet Clin North Am Small Anim Pract [Internet]. 2020;50(5):1001–11. Disponible en:: http://dx.doi.org/10.1016/j.cvsm.2020.05.002
-
Tasker S. Diagnosis of feline infectious peritonitis: Update on evidence supporting available tests. J Feline Med Surg [Internet]. 2018;20(3):228–43. Disponible en: http://dx.doi.org/10.1177/1098612X18758592
-
Center for Veterinary Medicine. FDA announces position on use of compounded GS-441524 to treat FIP [Internet]. U.S. Food and Drug Administration. FDA; 2024 [cited 2024 Oct 23]. Disponible en: https://www.fda.gov/animal-veterinary/cvm-updates/fda-announces-position-use-compounded-gs-441524-treat-fip
-
FIP treatment GS-441524 - now available in the U.S [Internet]. Cornell University College of Veterinary Medicine. [cited 2024 Oct 23]. Disponible en: https://www.vet.cornell.edu/departments-centers-and-institutes/cornell-feline-health-center/health-information/feline-health-topics/fip-treatment-gs-441524-now-available-us
-
Taylor S, Tasker S, Gun-.More D, Barker E, Sorrel S. An update on treatmet of FIP in the UK. Internacional Society of feline Medicine
-
Delaplace M, Huet H, Gambino A, Le Poder S. Feline Coronavirus antivirals: A review. Pathogens [Internet]. 2021;10(9):1150. Disponible en: http://dx.doi.org/10.3390/pathogens10091150



